Medische bedden worden ook wel medische bedden, medische bedden, verpleegbedden etc. genoemd. Het zijn bedden die door patiënten worden gebruikt wanneer ze in het ziekenhuis worden opgenomen. Ze worden voornamelijk gebruikt in grote ziekenhuizen, gezondheidscentra in townships, gemeenschapsgezondheidscentra, enz.
De Amerikaanse FDA vereist dat wanneer voedsel en medische producten op de Amerikaanse markt komen, ze op de officiële website van de Amerikaanse FDA moeten worden geregistreerd voordat ze op de Amerikaanse markt kunnen komen.
Ziekenhuisbedden worden door de FDA geclassificeerd als medische hulpmiddelen van klasse I. De Amerikaanse Food and Drug Administration definieert apparaten van klasse I als “niet bedoeld om te worden gebruikt om het leven in stand te houden of om belangrijk te zijn bij het voorkomen van schade aan de menselijke gezondheid, en mogen geen potentiële” apparaten vormen die een onredelijk risico op ziekte of blessure." Deze apparaten vormen de meest voorkomende categorie apparaten die wordt gereguleerd door de FDA, goed voor 47% van de goedgekeurde apparaten op de markt. Apparaten van klasse I hebben minimaal patiëntcontact en hebben een minimale impact op de algehele gezondheid van de patiënt. Doorgaans komen Klasse I-apparaten niet in contact met de interne organen, het centrale zenuwstelsel of het cardiovasculaire systeem van de patiënt. Deze apparaten zijn onderworpen aan minimale wettelijke vereisten.
FDA-certificering van medische hulpmiddelen omvat: registratie van de fabrikant bij de FDA, FDA-registratie van producten, registratie van productvermeldingen (510-formulierregistratie), productvermelding (PMA-beoordeling), etikettering en technische transformatie, douane-inklaring, registratie en pre-market-rapportage van medische en gezondheidszorghulpmiddelen. De volgende materialen moeten worden ingediend:
(1) Vijf exemplaren van volledig verpakte eindproducten
(2) Structuurdiagram van het apparaat en tekstbeschrijving
(3) Prestaties en werkingsprincipe van het apparaat
(4) Veiligheidsdemonstratie- of testmateriaal van het apparaat
(5) Inleiding tot het productieproces
(6) Samenvatting van klinische onderzoeken
(7) Productinstructies. Als het apparaat radioactieve eigenschappen heeft of radioactieve stoffen vrijgeeft, moet dit gedetailleerd worden beschreven.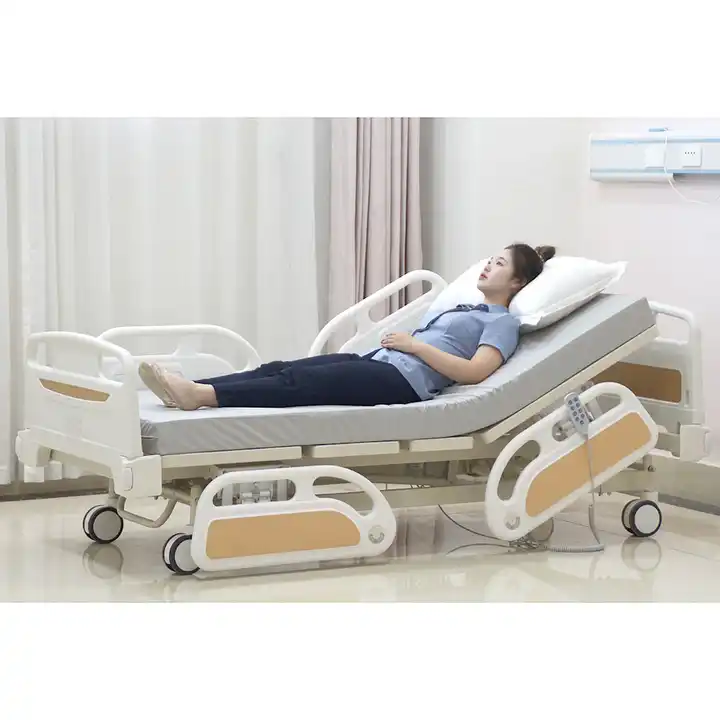
Projectcyclus
De tijd vanaf de evaluatie door de FDA tot de definitieve goedkeuring is over het algemeen langer en wordt gecontroleerd door de FDA; doorgaans bedraagt de gehele normale procescyclus ongeveer 12 maanden
Het aanvraagproces voor 510K voor ziekenhuisbedden is als volgt:
1. Nalevingsvereisten voor technische documenten van de FDA 510(K).
2. Standaardanalyse van toepassing op registratie bij de Amerikaanse FDA 510k
3. Bevestiging van beschikbaarheid van bestaande documenten
4. Verzameling en vergelijking van geregistreerde producten op de markt
5. Bereid productinformatie voor in overeenstemming met de vereisten van de Amerikaanse FDA 510k
6. Bereid 510k-registratiedocumenten voor volgens de normen
7. Breng herzieningen aan op basis van de beoordelingsresultaten van de registratiedocumenten
8. Voltooi de bedrijfsregistratie en registratie van productvermeldingen
taishaninc heeft een wereldwijde exportcertificering
Het heeft 5 volledige dochterondernemingen
Met betrekking tot de bouwmaterialen-, chemicaliën- en medische apparatuurindustrie
Wij zijn een fabriek met wereldwijde exportcertificering, met een jaarlijkse productiewaarde van $ 5.000.000 en export naar meer dan 160 landen over de hele wereld. Wij zijn de grootste geïntegreerde industrieparkfabriek in de omgeving. Neem indien nodig tijdig contact met ons op en stuur gedetailleerde productinformatie.
Posttijd: 21 november 2023




